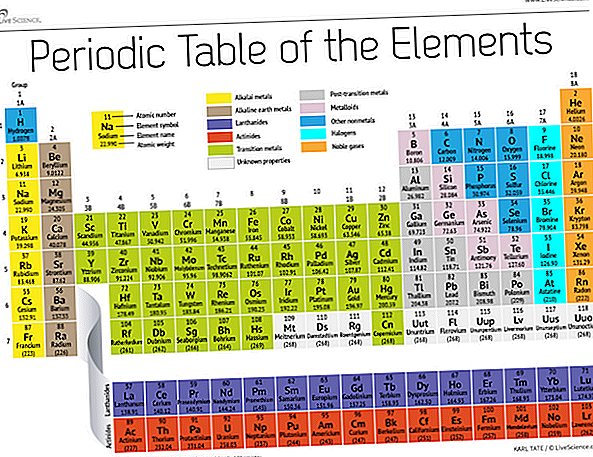
19. yüzyılın sonlarında, Rus kimyacı Dmitri Mendeleev kimyasal elementleri atom ağırlıklarına göre gruplandırma konusundaki ilk girişimini yayınladı. O zamanlar sadece yaklaşık 60 element biliniyordu, ancak Mendeleev elementler ağırlıkça düzenlendiğinde, belirli element tiplerinin düzenli aralıklarla veya periyotlarda meydana geldiğini fark etti.
Bugün, 150 yıl sonra, kimyagerler 118 elementi resmen tanıyor (2016'da dört yeni gelen eklendikten sonra) ve hala onları düzenlemek için Mendeleev'in periyodik element tablosunu kullanıyorlar. Tablo, en basit atom olan hidrojen ile başlar ve daha sonra elementlerin geri kalanını, her birinin içerdiği proton sayısı olan atom sayısına göre düzenler. Bir avuç istisna dışında, elemanların sırası her bir atomun artan kütlesine karşılık gelir.
Tabloda yedi satır ve 18 sütun vardır. Her satır bir periyodu temsil eder; bir elementin periyot sayısı, enerji seviyelerinden kaçının elektron içerdiğini gösterir. Örneğin, sodyum üçüncü dönemde oturur, yani bir sodyum atomunun tipik olarak ilk üç enerji seviyesinde elektronları vardır. Masayı aşağı doğru hareket ettirmek, daha büyük ve daha karmaşık dış seviyeleri doldurmak için daha fazla elektron gerektirdiği için süreler daha uzundur.
Tablonun sütunları, öğelerin gruplarını veya ailelerini temsil eder. Bir gruptaki elementler genellikle benzer şekilde görünür ve davranırlar, çünkü en dış kabuklarında aynı sayıda elektrona sahiptirler - dünyaya gösterdikleri yüz. Örneğin, masanın en sağındaki grup 18 elementleri tamamen tam dış kabuklara sahiptir ve nadiren kimyasal reaksiyonlara katılır.
Elemanlar tipik olarak bir metal veya ametal olarak sınıflandırılır, ancak ikisi arasındaki bölme çizgisi bulanıktır. Metal elemanlar genellikle iyi elektrik ve ısı iletkenleridir. Metaller içindeki alt gruplar, bu koleksiyonların benzer özelliklerine ve kimyasal özelliklerine dayanmaktadır. Periyodik tablo tanımımız Los Alamos Ulusal Laboratuvarı'na göre yaygın olarak kabul edilen eleman gruplarını kullanmaktadır.
Alkali metaller: Alkali metaller, tablonun ilk sütunu olan Grup 1'in çoğunu oluşturur. Bir bıçakla kesmek için yeterince parlak ve yumuşak olan bu metaller lityum (Li) ile başlar ve fransiyum (Fr) ile biter. Ayrıca son derece reaktiftirler ve alevle patlarlar, hatta suyla temas ettiğinde patlarlar, böylece kimyagerler onları yağlarda veya inert gazlarda saklarlar. Hidrojen, tek elektronu ile de Grup 1'de yaşar, ancak gaz ametal olarak kabul edilir.
Alkali toprak metalleri: Alkalin toprak metalleri, berilyumdan (Be) radyuma (Ra) kadar periyodik tablonun Grup 2'sini oluşturur. Bu elementlerin her birinin en dış enerji seviyesinde iki elektron vardır, bu da alkali toprakları doğada nadiren bulunabilecek kadar reaktif hale getirir. Ancak alkali metaller kadar reaktif değildirler. Kimyasal reaksiyonları tipik olarak alkali metallere kıyasla daha yavaş oluşur ve daha az ısı üretir.
Lantanitler: Üçüncü grup, üçüncü sütuna sığmayacak kadar uzundur, bu nedenle kırılır ve masanın dibinde yüzen adanın en üst sırası olmak için yana doğru çevrilir. Bu lantanidler, elementler 57 ila 71 - lantan (La) ila lutenyum (Lu). Bu gruptaki elementler gümüşi beyaz bir renge sahiptir ve hava ile temas ettiğinde kararır.
Aktinitlerin: Aktinidler adanın alt sırasını sıralar ve elementler 89, aktinyum (Ac), 103 ila lawrencium (Lr) içerir. Bu elementlerden Dünya'da sadece toryum (Th) ve uranyum (U) doğal olarak önemli miktarlarda oluşur. Hepsi radyoaktif. Aktinitler ve lantanitler birlikte iç geçiş metalleri olarak adlandırılan bir grup oluştururlar.
Geçiş metalleri: Tablonun ana gövdesine dönersek, 3 ila 12 arasındaki Grupların geri kalanı geçiş metallerinin geri kalanını temsil eder. Sert fakat yumuşak, parlak ve iyi iletkenliğe sahip olan bu elementler, metal kelimesini duyduğunuzda genellikle düşündüğünüz unsurlardır. Altın, gümüş, demir ve platin dahil olmak üzere metal dünyasının en büyük hitlerinin çoğu burada yaşıyor.
Geçiş sonrası metaller: Metal olmayan dünyaya atlamaktan önce, paylaşılan özellikler dikey grup çizgileri arasında düzgün bir şekilde bölünmemiştir. Geçiş sonrası metaller alüminyum (Al), galyum (Ga), indiyum (In), talyum (Tl), kalay (Sn), kurşun (Pb) ve bizmut (Bi) 'dir ve Grup 13 ila Grup 17'yi kapsar. Bu elementler geçiş metallerinin klasik özelliklerinden bazılarına sahiptir, ancak diğer geçiş metallerinden daha yumuşak olma ve daha zayıf hareket etme eğilimindedirler. Birçok periyodik tablo, astatinli diyagonal bağlantı borunun altında kalın bir "merdiven" çizgisine sahip olacaktır. Geçiş sonrası metaller bu çizginin sol alt kısmına kümelenir.
metaloidler: Metaloidler bor (B), silikon (Si), germanyum (Ge), arsenik (As), antimon (Sb), tellür (Te) ve polonyumdur (Po). Metallerden metal olmayanlara aşamalı geçişi temsil eden merdiveni oluştururlar. Bu elemanlar bazen iletkenlerden ziyade yarı iletkenler (B, Si, Ge) gibi davranırlar. Metaloidlere "semimetaller" veya "zayıf metaller" de denir.
ametaller: Merdivenin sağ üst tarafındaki her şey - artı Grup 1'de geriye doğru giden hidrojen (H) - ametal değildir. Bunlar arasında karbon (C), azot (N), fosfor (P), oksijen (O), kükürt (S) ve selenyum (Se) bulunur.
Halojenler: Grup 17'nin flortan (F) astatine (At) kadar olan ilk dört elemanı, metal olmayan iki alt kümeden birini temsil eder. Halojenler kimyasal olarak oldukça reaktiftir ve çeşitli tuz türleri üretmek için alkali metallerle eşleşme eğilimindedir. Mutfağınızdaki sofra tuzu, alkali metal sodyum ile halojen klor arasındaki bir evliliktir.
Soy gazlar: Renksiz, kokusuz ve neredeyse tamamen reaktif olmayan, inert veya asal gazlar Grup 18'deki tabloyu tamamlar. Birçok kimyager, yeni adlandırılan dört elementten biri olan oganesson'un bu özellikleri paylaşmasını bekler; bununla birlikte, bu elementin milisaniye içinde yarılanma ömrü ölçümü olduğundan, hiç kimse doğrudan test edememiştir. Oganesson periyodik tablonun yedinci dönemini tamamlar, bu yüzden eğer herhangi biri element 119'u sentezlemeyi başarırsa (ve bunu yapmak için yarış zaten devam ediyorsa), alkali metal sütununda sekizinci sıraya başlamak için dönecektir.
Tabloya adını veren periyodikliğin yarattığı döngüsel doğa nedeniyle, bazı kimyagerler Mendeleev'in masasını bir daire olarak görselleştirmeyi tercih ediyor.
Ek kaynaklar: