Tüm moleküllerin belirli bir mesafe ile ayrılmış iki eşit ve zıt yüke sahip olduğu uzun zamandır bilinmektedir. Bu tür polar moleküller söz konusu olduğunda, negatif yükün merkezi pozitif yükün merkezi ile çakışmaz. Bu tür kovalent moleküllerde polarite derecesi, esasen bir polar kovalent bağdaki polaritenin ölçüsü olan Dipol Moment terimi ile açıklanabilir.
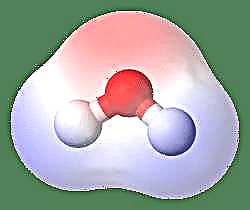
Bir dipolün en basit örneği bir su molekülüdür. Bir su molekülü, elektronlarının “bükülmüş” bir yapıda eşit olmayan paylaşımı nedeniyle kutupsaldır. Su molekülü, uçlarda hidrojen atomları ve tepe noktasında oksijen bulunan bir açı oluşturur. Oksijen hidrojenden daha yüksek bir elektronegatifliğe sahip olduğundan, molekülün oksijen atomuna sahip tarafı kısmi negatif bir yüke sahipken, merkezdeki hidrojen kısmi bir pozitif yüke sahiptir. Bu nedenle, dipol momentinin yönü oksijene işaret eder.
Fizik dilinde, elektrik dipol momenti, bir yük sisteminde pozitif ve negatif elektrik yüklerinin ayrılmasının, yani yük sisteminin genel polaritesinin bir ölçüsüdür - yani, elektrik yükünün moleküllerinin ayrılması, bir dipole yol açar. Matematiksel olarak ve biri yükü + q ve yükü? Q olan iki nokta yükünün basit durumunda, elektrikli dipol momenti p şu şekilde ifade edilebilir: p = qd, burada d negatif yükten pozitif yük. Böylece, elektrik dipol moment vektörü p negatif yükten pozitif yüke işaret eder.
Buna bakmanın bir başka yolu, Dipole Moment'i Yunanca m, m = ed harfiyle temsil etmektir; burada e, elektrik yükü ve d, ayırma mesafesidir. Debye birimlerinde ifade edilir ve D olarak yazılır (burada 1 Debye = 1 x 10-18e.s.u cm). Bir dipol momenti bir vektör miktarıdır ve bu nedenle pozitif merkezde bir kuyruk ve başı negatif bir merkeze dönük küçük bir okla temsil edilir. Bir Su molekülü durumunda, Dipol momenti 1.85 D iken, bir hidroklorik asit molekülü 1.03 D'dir ve şu şekilde temsil edilebilir:
Space Magazine için dipol momenti hakkında birçok makale yazdık. İşte suyun ne hakkında yapıldığı bir makale ve moleküller hakkında bir makale.
Dipol anı hakkında daha fazla bilgi edinmek isterseniz, Hyperphysics and Science Daily'nin bu makalelerine göz atın.
Ayrıca Uzaydaki Moleküller hakkında tüm bir Astronomi Oyuncusu bölümünü de kaydettik. Burada dinle, Bölüm 116: Uzaydaki Moleküller.
Kaynaklar:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule